Abstract megszerzése nátrium-hidroxid - elvonatkoztat Bank, esszék, jelentések, projektek és disszertációk
Nátrium-hidroxid, vagy marónátron (nátrium-hidroxid), klór, hidrogén-klorid, HC1 és hidrogén keletkezik az iparban jelenleg a módszer elektrolízisével nátrium-klorid-oldattal.
Nátrium-hidroxid vagy nátrium-hidroxid - erős lúggal, úgynevezett a mindennapi életben kausztikus alkalmazott szappan készítés, alumínium gyártása során - a prekurzor előállítására fém alumínium, a lakokra-lédús, petrolkémiai ipar, a termelés mesterséges selyem, a szerves szintézis ipar, és más ágai gazdaságban.
Amikor dolgozik klór, hidrogén-klorid, sósav és nátrium-hidroxid szükséges, hogy szigorúan tartsa be a szabályokat a szakterületen-veszély nélkül. klór- inhalációs okoz éles köhögés és nehézlégzés, Sun-palenie légúti nyálkahártyák, tüdőödéma, és további kialakulását gyulladásos gócok a tüdőben.
Hidrogén-klorid, még kevés tartalom a levegőben irritációt okoz az orrban és a torokban, bizsergés a mellkas, rekedtség és asztma. A krónikus mérgezés kis koncentrációban is különösen érinti a fogak zománc, amely gyorsan elpusztul.
Sósav mérgezés nagyon hasonlít a mérgezés klór.
Kémiai módszereket előállítására nátrium-hidroxid.
A kémiai eljárások közé tartozik a termelés a nátrium-hidroxid a vestkovy és ferrit.
Lime előállítási módjának nátrium-hidroxid előállítására egy szóda oldatot mésztej ütemben-séklet körülbelül 80 ° C-on Ezt nevezik causticizing; le van írva elő
Na2C03 + Ca (OH) 2 = 2NaOH + CaC03 (1)
Az (1) reakciót úgy állítjuk elő nátrium-hidroxid-oldatot, és kicsapja a kalcium-karbonát. A kalcium-karbonátot elválasztjuk az oldatból, CO-tory bepároljuk, így olvadt termék körülbelül 92-zhaschego% NaOH. Olvadt NaOH öntjük azonos Leznov dobok ahol megszilárdul.
Ferrites által leírt módszer két reakció:
Na2C03 + Fe203 = Na20 • Fe203 + C02 (2)
Na20 • Fe203 -f H20 = 2 NaOH + Fe2O3 (3)
Reakció (2) mutatja a szinterezési folyamat a szóda vas-oxid-hőmérsékleten 1100-1200 ° C-on Így on-spec razuetsya - nátrium-ferrit és a szén-dioxid szabadul fel. További spec kezelt (mosódott) vizet szerinti reakció (3); kapott oldatot nátrium-hidroxid, és a csapadékot Fe2O3, amely, miután annak elválasztását a oldatot visszavezetjük az eljárásba. Az oldat körülbelül 400 g / l nátrium-hidroxid. A bepárolva pro-a terméket, amely körülbelül 92% -os NaOH.
Kémiai módszereket előállítására nátrium-hidroxid-WIDE lényeges hátrányai: a nagy mennyiségű elfogyasztott üzemanyag, előállíthatók az én-szennyezett marónátron szennyeződések munkaigényes és egyéb szolgáltató járművek Jelenleg ezek a módszerek szinte teljesen kiszorította a elektrokémiai termelési módszer ..
A koncepció az elektrolízis és elektrokémiai folyamatok.
Elek-po- folyamatok nevezett kémiai folyamatok pro-Tek vizes oldatok vagy hatására megolvad állás-elektromos árammal.
Oldatok vagy olvadékok sók, savas és lúgos oldatok, Vai nevezett elektrolitok kapcsolódnak a vezetékek a második fajta, amelyben elektromos áram által szállított ionok transzfer. (A vezetékek az első fajta, mint például a fémek, a jelenlegi hajtjuk elektronokkal.) Amikor a átfolyó villamos áram segítségével a elektron-Trol kisülés keresztül fordul elő az elektródok és az ion-os állás kiosztott korom anyagok. Ezt a folyamatot nevezik az elektrolízis. Az egység, amelyben az elektrolízis az úgynevezett elektron-trolizerom vagy elektrolit fürdőben.
Elektrolízis előállítására használják számos pro-kémiai duktov- klórt, hidrogén, oxigén, alkáli- és mások. Tit, meg kell jegyeznünk, hogy a kapott elektrolízissel vegyi SEASON Coy tisztaságú, néhány esetben, megközelíthetetlen kémiai eljárások ezek előállítására.
A hátrányok elektrokémiai folyamatok közé tartozik a magas energiafogyasztás az elektrolízis során, ami növeli a költségeket a kapott termékek. Ezzel kapcsolatban magatartás-nek elektrokémiai folyamatok célszerű csak az alapján az olcsó villamos energia-CIÓ.
Nyersanyagok előállításához nátrium-hidroxid.
Előállításához nátrium-hidroxid, klór, hidrogén-klorid-oldatot használunk, amely ki van téve, hogy elektrolízis Nátrium-klorid megtalálható a természetben formájában földalatti kősólerakódások a vizek a tavak és tengerek és egy természetes Russo-halászat vagy oldatok. Kősólerakódások vannak donyeci a Ural, szibériai, Zak-Cazier és egyéb területeken. Gazdag só hazánkban, és néhány a tóra.
A nyári időszakban a párologtatás víz felszínére tavak és Powa rennaya-só kicsapódik, mint a kristály-halászat. Az ilyen só-nevezett samosadoch sósav. Tengervízben akár 35 g / l nátrium-kloridot. Forró égöv ahol az in-párolgás intenzitását a képződött víz tömény oldatok nátrium-klorid, amelyből zuetsya kristály. A belső tér a Föld, talajvíz áramlását Sóképződés hogy feloldódjon NaCl és forma földalatti sóoldatokban, amely átnyúlik a fúrási kútból a felszínre.
Sóoldatok, függetlenül az útvonalat az előállításukra szennyeződéseket tartalmazhatnak kalcium- és magnézium-sók, és mielőtt azok át az elektrolízis egység, podver gayutsya-tisztított ezek a sók. Tisztítás azért szükséges, mert az elektrolízis során képezhetnek rosszul oldódó hidroxidok kalcium és magnézium, amelyek megsértik a rendes elektrolízis.
Tisztítás brines előállított oldat szóda és mész tejet. Amellett, hogy a kémiai tisztító oldatok bozhdayutsya-elsajátította a mechanikai szennyeződésektől, amelyet ülepítéssel és szűréssel.
Elektrolízis nátrium-klorid oldat keletkezik fürdők a szilárd vas (acél) és a katód a membránnal, és a fürdő folyékony higanykatódos. Mindenesetre, az ipari elektron-rolizery használt gépek a mai nagyméretű klór-alkáli növényeket kell nagy teljesítményű, pro-stuyu szerkezet kompakt, megbízhatóan működnek és a felépítmény-Chivo.
A nátrium-klorid elektrolízisével megoldások fürdők acél katód és grafit anód.
Ez lehetővé teszi a termelés a nátrium-hidroxid, klór és a hidrogén egyetlen berendezésben (elektrolitikus cella). Amikor halad közvetlen elektromos áram segítségével vizes nátrium-klorid-várható alakulását klór:
2CI- - 2e Yu C12 (a)
és oxigén:
20N- - 2nd Yu 1 / 2O2 + H 2O (b)
Normál elektród potenciálját a kisülési OH - ionok kívánnak létrehozni composition- + 0,41, és a rendes elektród potenciálját a kisülési kloridionok egyenlő + 1,36. Semleges oldatban, telített nátrium-klorid-koncentrációja körülbelül 1-hidroxil-ion # 903 10-7 g-ekvivalens / l. 25 ° C-on egyensúlyi potenciálja a kisülő-hydroxyechinenone nehéz ionok
Egyensúlyi potenciál kisülési kloridionok koncentrációban NaCl-tését a 4,6 g-ekvivalens / l egyenlő
Ezért, az anód alacsony túlfeszrelé elsőként kell lemerült oxigént.
Azonban, a grafit anódok oxigén túlfeszültség sokkal magasabb klór- túlfeszültség, és ezért lesz elsősorban C1 mentesítés ionok felszabadulását klórgázt által a reakció az (a).
klórt izolálása megkönnyíti növelésével NaCl koncentrációja az oldatban csökkenése miatt a ebben a mennyiséggel egyenlő Spring kapacitást. Ez az egyik oka a felhasználásra az elektrolízis egy koncentrált nátrium-klorid-tartalmú oldatok 310-315 g / l.
A katódon lúgos oldatban a víz leeresztését a molekulák az alábbi egyenlettel
H20 + e- = H + OH- (c)
A rekombinációt követően a hidrogénatomok formájában kicsapatjuk egy mól molekuláris hidrogén,
Mentesítés nátriumionok vizes oldatokból szilárd katód miatt nem lehetséges, hogy a nagyobb kapacitású kisülési képest hidrogénatom. Ezért hidroxid oldatban maradt - ionok nátrium-ionok, így a lúgos oldatot.
A bomlási folyamat fejezhető NaCl így fúj reakciók a következők:
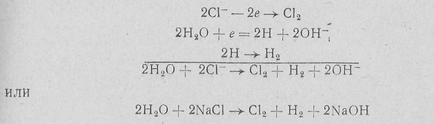
.. Azaz, az anód a klór képződést, és a katód - hidrogén és nátrium-hidroxid.
Az elektrolízis, együtt az alapvető leírt folyamatok lehet folytatni, és az oldalsó, egy egyenlet neniem ismertetett (b). Ezen túlmenően, a klór fejlődött az anódon részlegesen feloldjuk az elektrolitot és hidrolizáljuk oly módon,
Abban az esetben, diffúziója alkáli (OH- ionok), hogy az anód, illetve a katód és az anód előfeszítő terméket hipoklórsav és sósavat semlegesítjük lúggal hipoklorit és nátrium-klorid:
NOS1 + NaOH = nátrium-hipoklorit + H20
HC1 + NaOH = nátrium-klorid + H20
ClO- ionok az anódon is könnyen oxidálódik a ClO3-. Következésképpen, mellékreakcióiként az elektrolízis során jön létre hipoklorit,-klorid és nátrium-klorát, ami vezet egy csepp-niju jelenlegi hatékonyságát és energia felhasználás. A rés-emlő környezetben könnyebben felszabaduló oxigén az anódon, ami szintén rontja a teljesítményét elektrolízis.
Ahhoz, hogy csökkentsék a nem kívánt reakciók, legyen COS-adni feltételeket, amelyek megakadályozzák a keveredését katód és az anód pro-kek. Ezek közé tartozik szétválasztása a katód és az anód terek membrán és az elektrolit szűréssel egy membrán fedélzeti ellentétes mozgását OH-ionok az anód. Az ilyen membránok nevezzük nyílások és készült szűrő azbeszt.
Növelése az NaCl-koncentrációt és elektrolízis elektrolitoldat hőmérsékletét, amelyen keresztül oldhatósága csökken, a klór, valamint csökkenti a koncentrációja NaOH-ot a katolit kontrakció-schayut valószínűsége mellékreakciók.
Növelése az elektrolízis hőmérséklete nem csak növeli a jelenlegi hatékonyságát, hanem az elektromos vezetőképessége az elektrolit, amely csökkenti a cellafeszültséget. Így, a hőmérséklet emelkedése csökkenti az elektromos energia fogyasztását, és ezért általában elektrolízisével nátrium-klorid oldatok végezzük 70-80 ° C-on
Ipari elektrolizáló szűrővel-nek membrán széles körben használják az iparban. Vezetési ilyen fürdő ábrán látható. Bath 1 van egy perforált acél-MENT (lyukkal) katód és grafit anód. A katód szűk szűrőt membrán azbeszt fedélzeten.
A nátrium-klorid-oldatot táplálunk be a anódkamrából, átszűrjük a membrán, és eléri a katód. Az arány a szűrési elektrolit ha acterized úgynevezett folyóképességét apertúra v (cm3 / óra), attól függően, hogy a nyílás keresztmetszeti területe F (cm-1), h elektrolit hidrosztatikus nyomását. dia-phragma vastagsága b (cm) az elektrolit és a viszkozitás μ.
Amikor halad egy közvetlen elektromos áram előállított klórral az anódon, a katód - hidrogén és lúg, amely áthalad a by-Verstov katód ömlik a katódos tér és kivesszük a fürdőből.
fürdő áramkör egy szűrési Membrán:
1- membrán; 2 - acél katód;
3 - katód tér-CIÓ;
4 - egy anód; 5 - anód tér
A fürdőben nincs teljes bomlása só és
beállított konstans koncentrációja elbomlatlan alkáli- és sót.
Az elektrolitikus folyadékot származó effluenst a fürdő tartalmaz 110-120 g / l nátrium-hidroxid és 180-170 g / l nátrium-klorid.
Az ipari elektrolizáló lesz egy nagy termelőknek-clusive, ami úgy érhető el a terhelés növekedésével. Használata katód egy nagyon nagy felületű lehetővé teszi, hogy valaki kompakt elektrolizáló terheléssel akár 50.000. A membrán ebben az esetben nasasyvayut vagy „letétbe” a felszínen a katód a szuszpenziót azbesztszálak sóoldat-lúgos oldat segítségével vákuum.
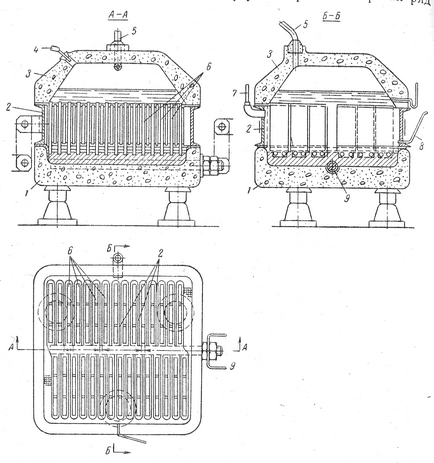
Ábra. 2. fürdő egy letétbe Membrán:
1- beton alján; 2 - acél katód; 3 - beton sapka; 4 - egy cső ellátására a sóoldat; 5 - egy cső elvezetésére klóratom; 6 - grafit anódok; 7 - szerelvény eltávolítása hidrogénatom; 8 - egy cső a csatorna az elektrolitikus folyadék; 9 - Réz áramvezető
Egy példa a fürdő a letétbe helyezett membrán szolgálhat fürdő típusú Hooker S, ábra. 2. Ez a fürdő három fő Cha stey - alsó beton, acél katód és a beton fedél. A vályú fenekét egy téglalap alakú, ahol a töltött-sertés Tzom alsó végei a grafit anódok és a réz bárban árambevezetőelemek. Grafit anódok pla-Stina. A katód - acél, amelyen belül van szerelve egy sor lapos zseb acélháló. Hely zsebek és szélessége olyan, hogy a telepítés a katód az alján úgy a zsebek vannak elhelyezve, hogy pontosan az anódok.
A fürdő fedél nyílások etetés sóoldattal és kisütés klórt. A cella hőszigetelés csökkenti az energia veszteséget hő miatt a környezetbe való kibocsátásra.
Elektrolízis megoldások anyát dence kloridot fürdők egy higanykatódos és grafit anód VYM.
Ez ad több koncentrált-fürdőszoba termékek, mint a fürdő egy membrán.
Amikor az áthalad egy NaCl oldattal DC-ég elektromos áram a grafit anód bekövetkezik a C1-ion kisülés a következő felszabaduló klórgáz
A higanykatódos, a hidrogén-fejlődés lép fel, egy nagy túlfeszültség. Ha a vas-katód potenciál hidrogén felszabadulását mutatja a semleges oldatot egyenlő 0,415, majd egy higanykatódos ez 1,7-1,85 a. Nátrium ugyanazon kibocsátott higany nagy hatással a depolarizáció által okozott nátrium NaHgn amalgámot alkot a lámpában, a higany feloldódó feleslegben. Bla Godard ezt a potenciált nátrium kisülő higany katód-JELÖLI kiderül, hogy az egyensúly alatti, nevezetesen 1,2, míg a még mindig-rugó potenciál egyenlő 2.71. Így a következő folyamatok játszódnak le egy higanykatódos:
hidrogén és gyakorlatilag szinte nem osztották.
Nátrium-amalgám van szétbontva speciális készülékkel - dekomponista vízzel történő reakcióval
NaHgn + H20 = NaOH + 1 / 2H2 + NHG
Elektrolízis fürdő higanykatódos áramlik átlagosan feszültségen 4,3-4,4 közé.
Bath higanykatódos, egy vázlatos diagram, ábrán látható. 3, két részből áll: Elektromos Leeser és bontó.
A sejt bontó és lehet konstruktívan Sec-Lena, és kommunikálnak egymással, vagy vezeték lehet elrendezve egy közös burkolat.
Mindenesetre, az elektrolizáló - egy hosszú téglalap alakú doboz-keresztmetszetű, tetején lefedjük, amelyben a megerősített grafit anódot. Ábra. 3. reakcióvázlat fürdő higanykatódos:
1- elektrolizáló; 2 - bontó anyagokat; 3 - Szivattyú
Az enyhén felfelé dőlt kád alján hozzuk Ka-todnaya gumiabroncs rajta, és folyamatosan mozgó vékonyréteg higany. Így, az alján a fürdő a katód. A sejt tápláljuk tömény (310-315 g / l) nátrium-klorid oldattal, hogy kimerült az elektrolízis során a közönséges só koncentrációra 260-270 g / l távozik a fürdő obeskhlorivaetsya alatti kisülés alatt végzett öblítés sűrített levegő, donasyschaetsya sót, tisztított szennyeződések (áramkör nem látható), és a továbbított vissza elektrolízis. Az így kapott klór kimenet segítségével a fürdő fedelet.
Amikor mozgó higany alján a cellás elektro-bérleti nátrium-amalgámmal kapunk, amelyet feloldunk higanyt és ki a cellát a bontó. Romboló lehetnek különböző konstrukciók - vízszintes és függőleges. Vízszintes károsító négyszögletes vályú visszazárt. A víz belép dekomponista és a kapott kivont termékek - hidrogén és alkáli. alsó