Mi a vegyértéke oxigént a vegyületek
Annak érdekében, hogy meghatározzuk a lehetséges értékek vegyérték oxigént kell vizsgálnia a helyzetet az elem a periódusos rendszerben, a fő jellemzői a szerkezet annak atomok. Ez a megközelítés hasznos a tanulmány azt a kérdést, hogy mi a vegyérték oxigén tipikus és mi nem jellemző rá. A leggyakoribb vegyületek mutatnak normális vegyértékét - II. Ez a funkció lehetővé teszi, hogy meghatározza a kötések egy másik atom a kész bináris képletek, ahol oxigént.
Mi a vegyérték oxigén?
A kezdeti szakaszban a felhalmozódása a tudás a tulajdonságait és szerkezetét vegyi anyagok gondoltak vegyértékének - a képességét, hogy kötődni bizonyos atomok száma a molekulában az anyag. Sok tudós felfedezése után az elem próbálták megérteni, mi a vegyérték az oxigén. Response kaptuk, kísérlet: oxigén tulajdonít két egyértékű hidrogénatom a kémiai reakció, az azt jelenti, kétértékű. Reprezentációi változatos kémiai kötéssel kapcsolódik a tudás felhalmozása a szerkezet az anyagok. Az ő elmélete a vegyértéke H. Lewis és W. Kossel nyilvánosságra a természet a kémiai kölcsönhatás az elektronikus szerkezet szempontjából. A kutatók magyarázatot az atom képes alkotni egy bizonyos számú kapcsolatot törekvés a legstabilabb energia állapot. Abban az esetben, hogy megvalósuljon a legkisebb szemcse az anyag stabilabb lesz. Az elmélet és Lewis struktúrák sok figyelmet fordítanak a szerepe a külső elektronok létrehozásában részt vevő kémiai kötés.
Tulajdonságok oxigén elhelyezése a periódusos
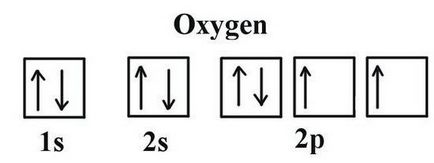
Annak érdekében, hogy meghatározzuk, amelyek a vegyérték az oxigén, akkor figyelembe kell venni néhány jellemzője az elektronikus szerkezet. Oxigén fejcsoportja 16 a periódusos rendszer. A közös neve a családtagok - „oxigéncsoport” elavult besorolás tartoznak VI (A) csoport. A periódusos oxigén van egy sejt alatt №8. A mag tartalmazza az összetételében a 8. és azonos számú pozitív semleges elemi részecskék. A tér egy atom, két energia szintjét, amelyek akkor jelentkeznek, amikor az elektronok 8, 6 amelyek - a külső.

Milyen kapcsolat áll fenn a készítmény az atom és a vegyérték?
Az utolsó szintre az oxigénatom két párosítatlan elektront. Az elem fluor gyengébb az érték a elektronegativitási (képesség, hogy vonzó kötőelektronok pár). A formáció a vegyületek más elemekkel oxigénnel vonzza felmerült a molekulában összesen elektronsűrűség (kivéve fluor- elektronok). Elérve az egyensúlyi állapot a külső héj esetleg további két negatív töltést. Ez azt jelenti, hogy az oxigén szükséges 2 elektront. Lehetséges alábbi lehetőségek: fogadja egy elektron (vegyérték II), távol a többi atom 2 elektront (vegyérték II), nem felvesznek elektronokat más atomok (0 vegyérték). Tipikus oxigén viselkedését jellemzi a második esetben. Így tudod használni, hogy megtudja, mi a vegyérték az oxigén a legjellemzőbb közös vegyületeket. Ezek közé tartozik a legtöbb oxidok fémek és nemfémek.
Hogyan működik egy vegyértékű vegyületekben?
Oxigén képes, hogy közvetlen kapcsolatot számos kémiai elemek. Ismert vegyületei, gyakorlatilag az összes képviselői a periódusos táblázat (kivéve az inert gázok az argon, hélium, neon). A reakciót halogénekkel és nemes fémek, oxigén közvetlenül nem adja meg, de oxidok Au2 O3. F2 O, Cl2 O7 és mások léteznek (közvetve kapott). A bináris vegyületek képződését oxigén vesz részt, azzal jellemezve, hogy egy kovalens kötés és a polaritást. Vegyértéket ilyen molekulák számától függ bármely elektron pár, amely vonzza a sejtmagba különböző atomok. A túlnyomó többsége a vegyületek az oxigén atomok vesznek részt a létrehozását két kovalens kötéssel. Például, az oxidok a CO2. P2 O5. SO2. SO3. K2 O, B2 O3. NO2 O5 és más molekulák. A kation oxónium H3 O + oxigént mutat atípusos neki vegyértékű III. A jelenléte peroxo -OO- okozta szokatlan a hidrogén-peroxid H2 O2. Ez vegyület jellemző oxigéntől vegyérték II.
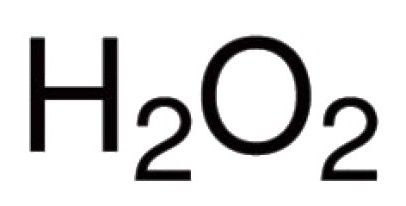
Hogyan állapítható meg, a vegyérték az elemek?
A koncepció a vegyérték oxigén ad lehetőséget Lewis szerkezet - kémiai szimbólum elem, amely körül elektronok pontok jelölje meg a külső réteg. Részt vesznek a létrehozását molekulák, amelyek részei a megosztott elektron párokat. Formula Lewis bizonyítja oxigént vegyértékű számának megfelelő annak párosítatlan elektront (2). Ugyanezt az eredményt kaptuk, elektronikus kép struktúrákat. A két sejtek a külső oxigén szintje található párosítatlan elektront (nyilak jelölik a képletben). További információt, amit a vegyértéke oxigén, amely lehetővé teszi a végső képletben a értéke bináris vegyület szomszédos atomokban. Ehhez végezze el az egyszerű számításokat. Először megszorozzuk a az O atomok száma a normál mérték az oxigén vegyérték. A kapott értéket el kell osztani az index meghatározott képlet a kémiai szimbólum közel van egy másik elem kombinálásával oxigénnel. Egy egyszerű módszer kiszámítjuk a szén és a foszfor vegyértékű azok oxidjai.
- Szorozzuk az index a jobb alsó a megjelölés D egy tipikus dioxid CO2 vegyértékű elem 2 • 2 = 4. A kapott számot elosztjuk index meghatározott szén-dioxid-: 4/1 = 4. A szén-dioxid CO2 a legmagasabb vegyérték-állapotú IV.
- Index alsó jel jobb a kémiai oxigén foszfor-oxid-P2 O5 szaporodnak a tipikus vegyérték atom O 5 • 2 = 10. Ez a szám szakadék az említett formula az index a jobb alsó a foszfor atomok: 10/2 = 5. A foszfor-oxid van a legmagasabb vegyérték-állapotban V.
