Stabilitás a komplex vegyületek
A megoldások komplex vegyületek egy olyan rendszer dinamikus egyensúly, azaz. E. Komplex vegyületek tárgyát egy nagy fokú elektrolitos disszociáció. Ionok vagy molekulák jelen a külső szférában, kötve a komplex sokkal gyengébb, mint az ionok vagy molekulák, a belső szférában. Az ilyen típusú kötés erőssége disszociációját okozza a komplex jellege a vegyületek.
Disszociációja komplexek zajlik szakaszban. Az első szakaszban komplex vegyületet disszociálódik, mint egy erős elektrolit, t. E. Szinte teljesen. Továbbá, a komplex ion, mint egy gyenge elektrolit disszociál szakaszosan, azaz. E. Elválasztott kompiexáióligandumoknak fokozatosan. Például, a disszociációja a komplex só [Ag (NH3) 2] Cl szerint jár a következő lépéseket:
Disszociációja a komplex csak kis mértékben, és lehet jellemezni a nagysága a teljes ionizációs állandója a komplex, amely a meghatározás szerint a termék a disszociációs állandók az egyes lépéseket. Így, ebben a példában
Minél nagyobb az értéke ez az állandó, annál komplex disszociál, az kevésbé stabil. Ez az állandó nevezik az állandó bizonytalanság. A reciprok instabilitása állandók úgynevezett stabilitási állandója:
instabilitás állandó különböző komplex ionok különböző, és lehet az intézkedés a komplex stabilitása. A legstabilabb a megoldások komplex ionok a legalacsonyabb instabilitás állandók. Például, többek között a vegyületek
komplex vegyületek
Oktatási k / s köszönhető, hogy a kationok Me kapcsolódó specifikus molekulákat és / vagy negatív töltésű ionok.
Cu2 ++ 4NH3 = [Cu (NH3) 4] 2+
NH3 + H + → NH4 +
[] - a kapcsolat erősségét, - donornoaktsektornaya Us
Ennek része a komplex ion tudja különböztetni ion-komplexképző Cu2 +, rokon molekula ligandumai ammónia (ligandumok - kapcsolódó ion / molekula vagy a otritsatelnozaryazhennye ionok) NH3.
Anionok - Neg / töltés ionok: OH-, Cl-, Br-, J-, CNS-, CN-
4 - koordináta száma [Cu (NH3) m], azaz a K / H mutatják a ligandumok száma csatolt ion-k / o.
Ion-k / o és a belső szféra ligandumok képezik a / a [...]. Ellenionok körülvevő komplex ion alkotják a külső gömb. A komplex töltésétől ion algebra töltések összege az ion-k / o és ligandumok. Ha ligandumok anionok, a díjat a komplex ion negatívvá válik.
[Cu (CN) 4] 2- CN- * 4 = -4 Cu = + 2 => -2
[Al (OH) 6] 3- - gidroksoalyuminat
Gyakran egy / h kétszeresével egyenlő mértékű ion-to / kb oxidációt. K / s lehet alkalmazni, hogy a különböző osztályok: sók, bázisok, savak.
Elvileg az építőiparban a nevét a / s (nominklatury) megőrzi a rendelkezések már elfogadott normál kapcsolatokat, de megvannak a maga sajátosságai. A név a C / S rögzített szerkezete jobbról balra, a komplex ion nevet (azaz, hogy a [...]) egymást követően átvisszük egy ligandumok száma, a nevét a ligandum, a nevét egy ion-k / o, és az alkalmazott anion latin-alapú szavak és a kation - orosz.
[Cu (NH3) 4] 2+ iont tetraaminmedi (II);
NH3-amin; CN-tseano
Ag (NH3) 2] + - ezüst-diamin-ion
[Al (H2O) 6] 3+ - alumínium-ion geksaakva
[Al (OH) 4] - - tetragidroksoalyuminat
[Cu (CN) 4] 2- - tetratsianokuprat (II)
[Al (OH) 6] 3- geksagidroksoalyuminat
[Fe (CN) 6] 3- - geksatsianoferat III
[Fe (CN) 6] 4- geksatsianoferat II
[Cu (NH3) 4] SO4 - tetramint réz-szulfát
K2 [Zn (OH) 4] - tetragidroksotsinkat kálium
K3 [Fe (CN) 6] 3- geksatsianoferat (III) kálium-
K4 [Fe (CN) 6] 3- geksatsianoferat (II) kálium-
[Cu (NH3) 4] (OH) 2 - réz II gidroaksidtetraamin
H2 [TiCl6] - geksahlortitanovaya savat
K / H R / H
Al3 + 4,6 Ag + 2
4 Zn2 + Hg + 2
Fe2 + 4,6 Hg2 + 4
Fe3 + 4,6
Az egyik módja annak, hogy megkapjuk / s bevezetésén alapuló kémiai a rendszerben, hogy hozzon létre egy feleslegben ligandumok megfelelő arányban a koordinációs száma. Ezen elv alapján oldódását reakciója némi csapadék, beleértve amfoter hidroxidok lúgos oldatokban.
Zn (OH) 2 (pellet) + 2KOH = K2 [Zn (OH) 4]
Zn (OH) 2 + 2OH - = [Zn (OH) 4] 2-
AICI3 + 3KOH = ↓ Al (OH) 3 + 3KCl
Al (OH) 3 + KOH = K [Al (OH) 4]
Al (OH) 3 + 3KOH = K3 [Al (OH) 6]
HgJ2 (oadok) + 2KJ = K2 [HgJ4] -2 - tetraiodogidroargat (II) kálium-
HgJ2 + 2J - = [HgJ4] 2-
Komplex vegyületek számos közös vegyületek tulajdonságait (pl: a csere reakciót, két só 3FeCl2 + 2K3 [Fe (CN) 6] = Fe3 [Fe (CN) 6] + 6KCL
3Fe2 ++ 2 [Fe (CN) 6] 3- = Fe3 [Fe (CN) 6])
K / s jellemző specifikus reakciók társított cseréje egy másik ligandum.
[Cu (H2O) 4] SO4 + 4NH3 = [Cu (NH3) 4] SO4 + 4H2O
[Cu (H2O) 4] 2 ++ 4NH3 = [Cu (NH3) 4] + 4H2O
CN-> NO2-> NH3> CNS-> H2O> OH-> Cl> Br> J- *
Képes helyettesíteni egy másik ligandumot társított erőt Komlov ionok. K / N komple ion növekszik az ereje ligandum (lásd fent tartomány *). Ligandumok található a bal oldali nazyv erős a jobb oldalon - gyenge (középpontjához viszonyítva).
Amikor vízben oldunk, hogy / a split típusú erős elektrolitok komple ionok és az ellenkező töltésű ionok a környezet.
K2Zn (CN) 4] → 2K ++ [Zn (CN) 4] 2-
[Cu (NH3) 4] SO4 → [Cu (NH3) 4] 2 ++ SO42
A vizes oldatok, ez a folyamat majdnem teljes egészében (elektrolit bomlást ion).
[Zn (CN) 4] 2- ← → Zn2 ++ 4CN- *
Jellemzésére az ion erőssége komple bevezette a: instabilitás állandók Kn, Kn amely a disszociációja az ion com *
Kn = (CZn2 + C4CN -) / C [Zn (CN) 4], ahol C - koncentráció, Kn-foglalt kézikönyvekben. Minél kisebb az érték Kn, annál erősebb Compel aktív ion.
12. feladat.
Szabvány alapján képződéshő # 916; H # 730; 298 és az abszolút entrópia S # 730; 298 anyagok határozzák meg: 1) # 916; H 730 #; 298 reakciót # 916; S # 730; 298 és a reakció # 916, a G # 730; 298 válaszokat. Következtetések a termodinamikai valószínűsége reakció standard körülmények között; 2) a hőmérséklet, amelynél, hogy egyensúlyi állandói, reakció egyenlő egy (# 916; G reakció jól lu). a hőmérséklet hatását # 916; H és # 916; S elhanyagolható reakció; 3) hőmérséklet-tartományban, amelyben az áramlás a reakció termodinamikailag valószínű. Számítások egyenletek tart-gödrök reakciók a táblázatban felsorolt.
A kémiai reakciók sebességének
A. A. Belyaev, VV Zagorski, E. A. Mengyelejev DI Mengyelejev V. Minaylov,
NI Morozova, A. E. falfestmény
- A kémiai reakció sebességét. Definíció.
- Befolyás a kémiai reakció sebessége.
- Nyomás hatása az arány a kémiai reakció.
- Hatás a felület érintkezési a reagensek a kémiai reakció sebessége.
- Hatása a természet a kémiai reagensek a reakció üteme.
- A hőmérséklet hatása az arány a kémiai reakció.
- Catalysis és a gátlás.
- kiegészítő anyag
- kísérletek
- feladatok
- teszt
Opciók 1-8. Számítsuk ki a hányszor növeli a sebességét-chem cal reakciók magasabb hőmérsékleten, amikor megadott-SG értéket.
Van't Hoff szabály - az ökölszabály, amely lehetővé teszi egy első közelítése, hogy értékelje a hőmérséklet hatását az arány a kémiai reakció egy kis hőmérséklet-tartományban (általában 0 ° C és 100 ° C). JH van't Hoff alapján több kísérletet megfogalmazott következő szabály:
Amikor a hőmérséklet emelkedik a 10 fokonként állandó homogén elemi reakció sebességét növeljük, 2-4 alkalommal.
Az egyenlet, amely leírja ezt a szabályt az alábbiak szerint:
ahol - a reakció sebessége a hőmérséklet. - a reakció sebessége a hőmérséklet. - hőmérsékleti együttható (ha 2, például, a reakció sebessége növekedni fog 2-szer növeli a hőmérsékletet 10 fok).
Nem szabad elfelejteni, hogy a van't Hoff-szabály csak akkor kell alkalmazni reakciók aktiválási energiája 60-120 kJ / mol közötti hőmérséklet-tartományban a 10-400 ° C-szabály van't Hoff szintén nem vonatkoznak reakciókat tartalmaznak, amelyek nagy térkitöltésű molekula, azaz például fehérjék biológiai rendszereket. A hőmérséklet függése a reakció sebessége pontosabban leírja az Arrhenius-egyenlet.
A van't Hoff hőmérsékleti együttható kiszámítása a képlet:
Speed homogén reakció - az anyagok számát a reagáltatandó vagy a reakciójával kialakított egységnyi idő egységnyi hogy a rendszer térfogata:
Más szóval, a homogén reakció sebessége egyenlő a változás a moláris koncentrációja bármely reagensek egységnyi idő. A reakció sebessége - a pozitív érték, így ha az expressziója révén koncentráció változtatása a reakciótermék tegye a „+” jel, míg a változó a koncentrációja a reagens jel „-”.
Írja kifejezése egyensúlyi állandó a bemutatott reverzibilis reakciót a táblázatban. Határozza meg, milyen száz Rhone-shift egyensúlyt a reverzibilis reakciók szerint: a) ha a rózsa-shenii hőmérsékleten (p = const); b) amikor a nyomás (T = const).
Exoterm reakció - egy kémiai reakció kíséri hőfejlődés. A szemközti endoterm reakció. Az energia teljes mennyisége a kémiai rendszer rendkívül nehéz mérni vagy számolni. Másrészt, a változás az entalpia # 916; H kémiai reakciók sokkal könnyebb mérni vagy számolni. Ezekre a célokra kaloriméterek. mért érték # 916; H kapcsolódik a molekula kötési energia az alábbiak szerint: # 916; H = energia töltött szakadás kötések (kötés-disszociációs energia) - a felszabaduló energia során a kötés képzésében a reakció termékek. Ez a képlet eredményez egy negatív értéket exoterm reakciók # 916; H, mivel a nagyobb értéket kivonjuk a kisebb érték. Amikor az égés a hidrogénatom, például: 2H2 + O2 → 2 H2 O egyenlő entalpia változást # 916; H = -483,6 kJ per mól O2.
Endoterm reakció (az ókori görög. # 7956; # 957; # 948; # 959; # 957; - és # 952; # 941; # 961; # 956; # 951; - hő) - kémiai reakciók kíséretében hő elnyelését. Endoterm reakciók, az entalpia változás a belső energia és pozitív értékeket (.) Ily módon, a reakció termék tartalmaz több energiát, mint az eredeti komponensek. Endoterm reakciók közé tartoznak:- fém redukciós reakciója oxidok,
- elektrolízis (elnyelt villamos energia)
- elektrolitos disszociáció (például, feloldjuk a sókat vízben)
- ionizálás
- fotoszintézis.
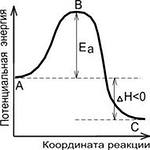

Hatása T, hogy elmozdulás a kémiai egyensúly. T növekvő Cr csökken exoterm reakciók és endoterm emelkedik.
Hatása p váltani kémiai egyensúlyt. Ha az arány a nem-egyensúlyi parciális nyomások (összhangban z.d.m.) kevesebb Kr. az egyensúly felé tolódik el a kialakulását termékek, ha több Kr. az egyensúly felé tolódik el a kialakulását a reagensek.
4. Az egyensúlyi reakció 2H2 (g) + O2 (g) 2H2 O (g); # 916; H <0 смещается вправо при:
1) a hőmérséklet növelésével; 2) a nyomás csökken; 3) egyre nagyobb a nyomás?
Minden anyagot a rendszerben - gázokat. Összhangban a Chatelier elv. nyomásnövekedés vezet elmozdulás az egyensúlyt a mellékreakciók és így a kevesebb mol gáz, azaz keletkezése irányába H2 O. Ezért a nyomásnövekedés a rendszer eltolja az egyensúlyi reakciót a jobb. Válasz: ha nő a nyomás.
5. milyen irányba tolódik az egyensúlyi reakció 2SO2 (g) + O2 (g) 2SO3 (g); # 916; H <0 при повышении температуры?
mint # 916; H <0, теплота выделяется в ходе прямой реакции, которая является экзотермической. Обратная реакция будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т.е. равновесие сместится в сторону исходных веществ.
Probléma 1. A rendszerben az A + C, # 916; H 0 <0, где А, В и С - газы, установилось равновесие. Какое влияние на равновесную концентрацию вещества С окажут: а) увеличение давления; б) увеличение концентрации вещества А; в) повышение температуры?
a) Ha az áramlás a reakció teljes mennyiségű gáznemű anyagok csökken 2-től 1. Összhangban a Le Chatelier elv nyomásnövekedés tolódik az egyensúly felé kisebb mennyiségű gáznemű anyagok (azaz képződése irányába anyag C), ezért, [C] növelése.
b) koncentrációjának növelése A anyag tolódik az egyensúly felé a termék képződését C, azaz a [C] növeli.
c) Mivel az # 916; H 0 <0, теплота выделяется, реакция - экзотермическая. Обратная реакция обязательно будет эндотермической. Повышение температуры всегда благоприятствует протеканию реакции с поглощением теплоты, т.е. равновесие сместится в сторону веществ А и В и [С] уменьшится.
Változatok 1-13. Hogyan változtatni a sebesség és a fordított reakció, ha a mennyiség a gázkeverék, hogy növelje (csökkenése) n-szer?
Nagyításhoz 4 alkalommal
1. Hányszor fogja változtatni a sebességét az előre reakció N2 (g) + 3H2 (g) 2NH3 (g), ha a rendszer nyomása megnövekszik a 2-szer?
Növelése a nyomás a rendszerben egyenértékű 2-szeres csökkenést a rendszer térfogata 2-szeres. Így a reaktánsok koncentrációja növeli 2-szer. A törvény szerint a tömeghatás. a kezdeti sebesség a reakció egyenlő VH = k · [N2] · [H2] 3. Amikor a nyomás növekedése 2-szer a nitrogén koncentrációja és hidrogén növeli 2-szer, és a reakció sebessége egyenlő lesz vk = k · 2 [N2] · március 2 [H2 ] 3 = k · 32 [N2] · [H2] 3. VCH kapcsolatot. / VH mutatja, hogy a változás a reakció sebességét, miután a nyomás változás. Következésképpen, VR / VH = k · 32 [N2] · [H2] 3 / (K · [N2] · [H2] 3) = 32. A: A reakció sebességét növeli a 32-szer.
Számítsuk ki: egyensúlyi állandója reverzibilis reakciót, a kezdeti és a egyensúlyi koncentrációja az összetevőket a rendszerek (a mennyiségeket kell kiszámítani vannak jelölve a táblázatban a x).