Típusú kémiai reakciók, diákélet

Módosításához az összetétele a következő típusú kémiai reakciók:
- a változás a készítményben (a többség);
- megváltoztatása nélkül a készítmény (izomerizációs és átalakítás egyik allotrop módosítás a másikra).
Ha az anyag nem okoz változást a reakció, arra van szükség, hogy változtassa meg a szerkezet, mint Cgrafit↔Calmaz
Nézzük meg a besorolás kémiai reakciók mennek végbe a változás a készítményben.
I. Szerint a száma és összetétele anyagok
Ennek eredményeként a kémiai folyamatok több anyagok előállított egyik: A + B + ... = C
- egyszerű anyagok: 2Na + S = Na2S;
- egyszerű összetett: 2SO2 + O2 = 2SO3;
- két észter: CaO + H2O = Ca (OH) 2.
- több mint két anyagot: 4Fe + 3O2 + 6H2O = 4Fe (OH) 3
Egy anyagot olyan reakciókban lehet bővíteni, hogy több más: A = B + C + ...
Termékek, ebben az esetben lehet:
- egyszerű anyagok: 2NaCl = 2Na + Cl2
- egyszerű és összetett: 2KNO3 = 2KNO2 + O2
- két észter: CaCO3 = CaO + CO2
- Több mint két termék: 2AgNO3 = 2Ag + O2 + 2NO2
Az ilyen reakciók, amelyek reagálnak között egyszerű és komplex anyag, az egyszerű anyag atomok szubsztituált atomok egyik eleme a komplex, és az úgynevezett szubsztitúciós reakciók. Vázlatosan, a folyamat a csere a atomok lehet kimutatni: A + B + BC = AC.
Például, CuSO4 + Fe = FeSO4 + Cu
Ebben a csoportban tartoznak reakció, amelynek során két észter anyag változó annak részei: AB + CD = AD + CB. A szabály szerint Berthollet, irreverzibilis során ezek a reakciók is lehetséges abban az esetben, ha legalább az egyik termék:
- kicsapódnak (oldhatatlan anyag): 2NaOH + CuSO 4 = Cu (OH) 2 + Na2SO4;
- malodissotsiiruyuschee szer: NaOH + HCI = nátrium-klorid + H2O;
- gáz: NaOH + NH4CI = nátrium-klorid + NH3 + H2O (kezdetben képződött hidrát ammónia NH3 • H2O, amely kézhezvételét azonnal bomlik ammónia és víz).
II. Termikus hatása
- Exoterm - folyamatok fordulnak elő hőfelszabadulási:
C + O2 = CO2 + Q - Endoterm - reakciók, ahol a hőt elnyeli:
Cu (OH) 2 = CuO + H2O - Q
III. Típusú kémiai reakciók irányába
- Úgynevezett reverzibilis reakciók előforduló egyidejűleg mind az előre és hátra irányban: N2 + O2 ↔ 2NO
- Irreverzibilis folyamatok zajlanak vége előtt, hogy van, mindaddig, amíg legalább az egyik a reagenseket használjuk fel teljesen. Példák a visszafordíthatatlan csere reakciók a fent tárgyalt.
IV. A katalizátor jelenlétében
- Katalitikus reakciók, mint a neve is mutatja, fordulnak elő katalizátorok jelenlétében:
- A nem-katalitikus reakció, a katalizátor nem használható.
V. A fizikai halmazállapot
- Ha a reagensek vannak ugyanabban az állapotban a aggregáció, a reakció az úgynevezett homogén. Az ilyen folyamatok zajlanak az egész kötetet. Például: NaOH + HCI = nátrium-klorid + H2O
- Úgynevezett heterogén reakciók között anyagokat található különböző államokban fellépő aggregálódás a határfelületen. Például: Zn + 2 HCI = ZnCI2 + H2 ↑
VI. A típusú kémiai reakciók változtatni az oxidáció mértékét reagensek
- Redox (OVR) - reakciók, amelyek megváltoztatják az oxidációs állapotban a reagensek.
- Reakciók változása nélkül oxidációs fokú reaktánsok (GIACS).
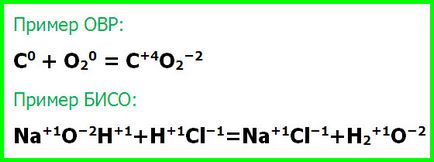
Mindig redoxifolyamatainak égő és a csere. csere reakciók lépnek változása nélkül szubsztanciák oxidációjának fok. Minden más folyamat lehet mind ISI és GIACS.